Jak obliczyć ładunek formalny CoCl2
Przy określaniu ładunku formalnego cząsteczki takiej jak CoCl2 (gaz fosgenowy), musisz znać liczbę elektronów walencyjnych dla każdego atomu i strukturę Lewisa cząsteczki.
Sprawdź każdy atom w układzie okresowym pierwiastków, aby określić liczbę elektronów walencyjnych.
Pamiętaj, że dwa elektrony trafiają do pierwszej powłoki s, dwa elektrony do drugiej powłoki s, sześć elektronów do pierwszej powłoki p, itd. Dla przypomnienia: 1s(^2)2s(^2)2p(^6)3s(^2)3p(^6)
Dostosuj do ładunku. Jeśli cząsteczka jest jonem, dodaj lub odejmij jeden lub więcej elektronów, aby uwzględnić ostateczny ładunek.
- Przy określaniu ładunku formalnego cząsteczki takiej jak CoCl2 (gaz fosgenowy), musisz znać liczbę elektronów walencyjnych dla każdego atomu i strukturę Lewisa cząsteczki.
- Jeśli cząsteczka jest jonem, dodaj lub odejmij jeden lub więcej elektronów ogółem, aby uwzględnić ostateczny ładunek.
Dla CoCl2 (gaz fosgenowy): C = 4; O = 6; Cl = 7. Cząsteczka nie jest zjonizowana i ma ładunek obojętny. Dlatego całkowita ilość elektronów walencyjnych wynosi 4 + 6 + (7x2) = 24.
Zobacz na diagramie strukturę Lewisa dla CoCl2 (gaz fosgenowy). Struktura Lewisa przedstawia najbardziej stabilną i prawdopodobną strukturę cząsteczki. Atomy są narysowane ze sparowanymi elektronami walencyjnymi; wiązania są utworzone pomiędzy samotnymi elektronami, aby spełnić regułę oktetu.
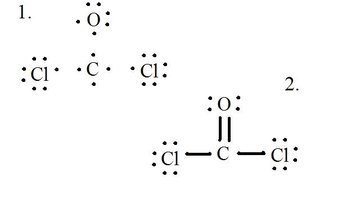
Narysuj każdy atom i jego elektrony walencyjne, a następnie utwórz wiązania w razie potrzeby.
Atomy chlorkowe mają pojedyncze wiązania z cząsteczką węgla, podczas gdy atom tlenu tworzy podwójne wiązanie z węglem. Każdy atom w końcowej strukturze spełnia regułę oktetu i ma osiem elektronów walencyjnych pozwalających na stabilność molekularną.
- Zobacz schemat struktury Lewisa dla CoCl2 (gaz fosgenowy).
- Każdy atom w końcowej strukturze spełnia regułę oktetu i ma osiem elektronów walencyjnych pozwalających na stabilność molekularną.
Licz samotne pary każdego atomu w strukturze Lewisa. Przypisz każdemu atomowi po jednym elektronie z każdego wiązania, w którym uczestniczy. Dodaj te liczby do siebie. W CoCl2: C = 0 par samotnych plus 4 elektrony z wiązań = 4 elektrony. O = 4 elektrony z par samotnych plus 2 elektrony z wiązań = 6 elektronów. Cl = 6 elektronów z par samotnych plus 1 elektron z wiązania z C = 7 elektronów.
Odejmij tę sumę od liczby elektronów walencyjnych w atomie niezwiązanym. Wynik to ładunek formalny dla tego atomu. W CoCl2: C = 4 elektrony walencyjne (v.e.) w atomie niewiązanym minus 4 elektrony przypisane w strukturze Lewisa (L.s.) = 0 ładunek formalny O = 6 v.e. - 6 L.s. = 0 ładunek formalny Cl = 7 v.e. - 7 L.s. = 0 ładunek formalny
- Odejmij sumę od liczby elektronów walencyjnych w atomie niewiązanym.
- W CoCl2: C = 4 elektrony walencyjne (v.e.)
Napisz te ładunki obok atomów w strukturze Lewisa. Jeśli cała cząsteczka ma ładunek, to ujmij strukturę Lewisa w nawiasy z ładunkiem zapisanym poza nawiasami w prawym górnym rogu.
UWAGA
Obliczanie ładunku formalnego dla cząsteczek zawierających metale przejściowe może być skomplikowane. Liczba elektronów walencyjnych dla metali przejściowych będzie równa liczbie elektronów poza rdzeniem przypominającym gaz szlachetny.
 Wyjasnijto
Wyjasnijto
